21 CFR Part 820(质量体系法规,QSR)
ISO 13485(FDA认可的自愿性标准)
产品特定规范(如510(k)/PMA批准内容)
| 检查类型 | 触发条件 | 检查深度 |
|---|---|---|
| 常规检查(BIMO) | 每2年一次(高风险产品) | 全面质量体系审查 |
| 批准前检查(PAI) | **申请510(k)/PMA时 | 聚焦设计控制和工艺验证 |
| 有因检查(For Cause) | 收到投诉/不良事件报告 | 针对性专项检查 |
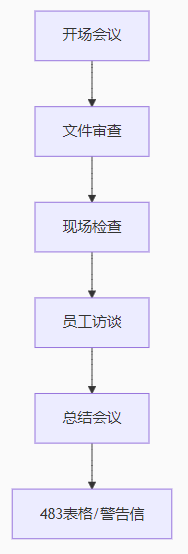
检查重点:
设计输入是否包含临床需求
设计验证是否覆盖所有预期用途
设计变更是否受控
常见不符合项:
设计评审记录缺失(占比42%)
未建立设计转移程序(占比28%)
检查重点:
特殊过程验证(如灭菌、焊接)
环境监测数据完整性
设备校准状态
常见不符合项:
工艺验证样本量不足(占比39%)
洁净区监控记录不完整(占比31%)
检查重点:
根本原因分析是否彻底
纠正措施有效性验证
跨系统联动(如与投诉处理关联)
常见不符合项:
CAPA未按时关闭(占比47%)
相同问题重复发生(占比33%)
检查重点:
质量目标可测量性
管理评审输入完整性
资源配备充分性
常见不符合项:
管理层未定期评审质量体系(占比25%)
培训效果未评估(占比18%)
检查重点:
文件变更历史追溯
作废文件管理
记录保存期限
常见不符合项:
未经批准使用草稿文件(占比36%)
电子签名未验证(占比22%)
检查重点:
投诉调查及时性
MDR报告合规性
趋势分析有效性
常见不符合项:
未在规定时限调查(占比41%)
投诉分类错误(占比27%)
典型案例:
仅进行3个批次验证(FDA期望统计学显著数量)
未覆盖*差条件
整改方案:
采用ASTM E2537指南确定样本量
补充*差条件验证(如*大/*小参数)
典型案例:
用"人员培训"作为所有问题的根本原因
未评估措施有效性
整改方案:
应用5 Why分析法确定真因
建立CAPA有效性指标(如6个月复发率)
典型案例:
用户需求未转化为可测量的设计输入
设计变更未重新验证
整改方案:
使用QFD(质量功能展开)工具转化需求
建立变更影响评估矩阵
典型案例:
关键供应商未定期审计
未建立物料分级标准
整改方案:
实施ABC分类法管理供应商
开发供应商质量记分卡(SQE)
典型案例:
手动记录涂改未说明原因
电子系统缺乏审计追踪
整改方案:
执行ALCOA+原则培训
部署合规数据管理系统(如LIMS)
进行模拟检查(Mock Audit)
准备主文件索引(MFI)
培训陪同人员(需熟悉QSR)
实施"1分钟响应规则"(快速提供请求文件)
记录检查员问题日志(每日汇总)
避免过度解释(仅回答被问问题)
15天黄金期:提交初步整改计划
根本原因分析:使用鱼骨图等工具
证据收集:附整改前后对比照片
预检差距分析:72小时输出风险报告
体系优化辅导:聚焦QSR与ISO 13485融合
模拟检查:前FDA检查官参与
483/WL应对:专业回复信撰写
案例1:帮助某骨科企业在收到483后20天内完成整改
案例2:为IVD厂商建立符合21 CFR Part 11的电子系统
案例3:重构跨国企业CAPA系统(复发率降低62%)
团队:包含前FDA审核员和QA总监
定制方案:根据产品类别和企业规模调整
持续支持:提供年度合规维护服务
立即联系角宿团队获取验厂支持方案!
上海角宿企业管理咨询有限公司专注于FDA510(K),N95认证,TGA注册,欧代注册,欧洲自由销售证明,MDR认证,ISO13485认证,SFDA注册,FDA注册等, 欢迎致电 17802157742在现代企业管理实践中,全面生产维护作为一种系统化的设备管理方法,正日益受到制造业企业的重视。它通过全员参与的自主维护活动,*大限度地提高设备综合效率,为企业实现降本增效提供有力支撑。TPM全面生产维护的核心内涵全面生产维护是一种以设备为中心的管理体系,其核心理念在于"全员参与、预防为主"。它强调从企业高层到员工的共同参与,通过建立自主维护机制,将设备保养意识融入每个生产环节。这种管理方式不仅关
在现代企业管理中,社会责任与道德贸易越来越受到重视。作为评估企业社会责任表现的重要工具,SMETA-4P认证已成为许多企业关注的重点。本文将围绕这一认证的相关内容,探讨其收费标准及影响因素,帮助企业更好地理解这一认证过程。认证的基本概念SMETA-4P认证是基于Sedex会员道德贸易审核的扩展版本,涵盖劳工标准、健康与安全、环境及商业道德四个核心模块。这一认证旨在全面评估企业在社会责任方面的表现,
在当今建设项目日益增多的环境下,如何选择一家合适的造价咨询服务机构成为许多项目负责人的关注焦点。一家优秀的造价咨询企业不仅能为项目提供专业支持,还能帮助客户规避风险、优化成本,确保工程顺利推进。那么,面对众多选择,我们应该从哪些方面进行考量呢?专业能力是核心要素首先,专业能力是评判一家造价咨询企业的关键标准。优秀的造价咨询机构通常具备全面的业务范围,能够覆盖项目从前期规划到后期结算的全过程。例如,
在当今快速发展的创新环境中,实用新型*作为一种重要的知识产权保护形式,为企业和个人提供了便捷高效的技术保护途径。对于安康市的创新主体而言,了解实用新型*的要求和申请流程,有助于更好地保护技术成果,提升市场竞争力。本文将详细介绍实用新型*的基本概念、申请条件、材料准备以及注意事项,帮助您全面掌握相关知识。实用新型*的基本概念实用新型*主要针对产品的形状、构造或其结合所提出的具有实用性的新技
利润突围
江苏利润突围公司:助力企业实现持续盈利增长在当今快速变化的市场环境中,企业面临着日益激烈的竞争和不断上升的成本压力。如何在这场没有硝烟的商战中实现利润突围,成为众多企业家和管理者关注的焦点。作为一家专注于商业思维训练的专业机构,我们自成立以来始终致力于帮助中小企业解决经营管理中的核心难题,为企业持续健康发展提供有力支持。理解利润突围的本质利润突围并非简单的成本削减或价格调整,而是一场涉及企业
17025认证咨询
在现代商业环境中,实验室作为科研与质量*的重要基地,其管理与技术水平直接影响着机构的公信力与市场竞争力。17025认证咨询作为专为实验室设计的一站式专业服务,旨在帮助实验室满足ISO/IEC 17025国际标准要求,获得国际认可的校准与检测实验室资格。对于许多机构而言,了解这项服务的费用构成及其价值,是迈向专业认证的第一步。本文将围绕17025认证咨询的核心内容,探讨其费用相关的因素,并分享如何





